Salute
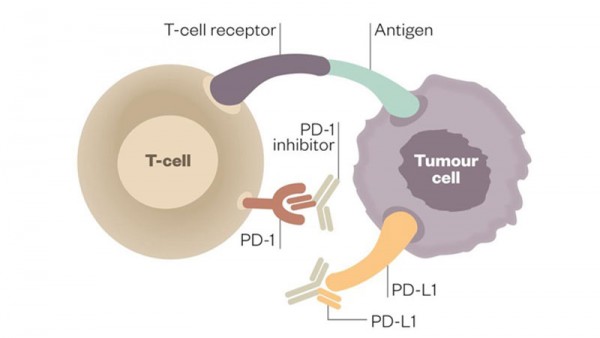
Nel 2016 in Italia ci sono stati 13.800 nuovi casi di melanoma. Nel corso del 53° Congresso dell’American Society of Clinical Oncology ( ASCO ), a Chicago negli Stati Uniti, sono presentati i risultati relativi al beneficio a lungo termine di Pembrolizumab ( Keytruda ), un anticorpo monoclonale anti-PD-1.
Lo studio di fase III KEYNOTE-006 ha coinvolto 834 pazienti con melanoma in stadio III inoperabile o IV avanzato, non-trattati in precedenza o che avevano già ricevuto una terapia in prima linea.
Dopo quasi tre anni ( 33.9 mesi ) il 50% dei pazienti trattati con Pembrolizumab era vivo rispetto al 39% dei pazienti che avevano ricevuto Ipilimumab ( Yervoy ).
Inoltre, Pembrolizumab ha anche raddoppiato il tasso di sopravvivenza libera da progressione ( 31% rispetto al 14% ) e le risposte obiettive hanno raggiunto il 42% con Pembrolizumab contro il 16% con Ipilimumab.
E’ stata anche condotta una sottoanalisi per valutare l’outcome dei pazienti ( n=104 ) che avevano completato i due anni di trattamento: in questa sottopopolazione, dopo un follow-up mediano di 10 mesi dalla sospensione; il 91% dei pazienti non ha presentato progressione della malattia.
Questi dati sono di fondamentale importanza anche al fine della definizione della durata della terapia, uno dei quesiti più importanti nel trattamento dei pazienti con inibitori del checkpoint immunitario.
La Commissione europea ha già approvato Pembrolizumab nel trattamento del melanoma avanzato ( non-operabile o metastatico ) negli adulti. L’approvazione da parte della Commissione europea di Pembrolizumab si era basata sui dati di tre studi clinici, KEYNOTE-001, KEYNOTE-002 e KEYNOTE-006, condotti su oltre 1.500 come terapia di prima linea e per i malati già trattati in precedenza affetti da melanoma avanzato.
Questi studi hanno valutato l’efficacia e la sicurezza di Pembrolizumab nei pazienti affetti da melanoma avanzato attraverso linee di trattamento, fattori di prognosi, caratteristiche dei tumori e stato mutazionale BRAF, e hanno determinato che la somministrazione di 2 mg/kg ogni 3 settimane rappresenta il dosaggio approvato.
KEYNOTE-001 è uno studio a braccio singolo, in aperto su Pembrolizumab ( 2 mg/kg ogni 3 settimane o 10 mg/kg ogni 2 o 3 settimane ) che ha incluso pazienti con melanoma avanzato trattati in precedenza con Ipilimumab ( e, in caso di positività alla mutazione BRAF V600, con un inibitore BRAF o MEK ) e i pazienti naïve a Ipilimumab.
In due coorti di pazienti con melanoma avanzato per il confronto dei dosaggi di Pembrolizumab, dei 140 pazienti sottoposti alla terapia approvata con dosaggio di 2 mg/kg ogni tre settimane, il tasso di risposta globale ( ORR ) ( endpoint primario ) per Pembrolizumab è stato del 33% nei pazienti naïve a Ipilimumab ( IC 95%, 21, 48 ) ( n=51 ) e del 25% nei pazienti già trattati con Ipilimumab ( IC 95%, 16, 35 ) ( n=89 ).
Gli endpoint secondari erano la sopravvivenza globale, la sopravvivenza libera da progressione e la durata della risposta per RECIST versione 1.1. I risultati sono risultati simili tra i diversi regimi posologici.
KEYNOTE-002 è uno studio clinico multicentrico, randomizzato, su Pembrolizumab ( 2 mg/kg ogni tre settimane oppure 10 mg/kg ogni tre settimane ) rispetto al trattamento chemioterapico stabilito dallo sperimentatore in 540 pazienti affetti da melanoma avanzato e precedentemente trattati con Ipilimumab e, in caso di mutazione positiva BRAF V600, un inibitore BRAF o MEK.
Gli endpoint primari erano la sopravvivenza libera da progressione e la sopravvivenza globale.
Entrambi i dosaggi di Pembrolizumab valutati hanno dimostrato risultati superiori rispetto alla chemioterapia per sopravvivenza libera da progressione a 6 e a 9 mesi, con tassi di sopravvivenza libera da progressione, rispettivamente del 34% e del 24%, per il dosaggio da 2 mg/kg ( IC 95%, 0.57 [ 0.45, 0.73 ] ) ( n=180 ) e del 38% e del 29% per il dosaggio da 10 mg/kg ( IC 95%, 0.50 [ 0.39, 0.64 ] ) ( n=181 ), rispetto al 16% e all’8% per il trattamento chemioterapico stabilito dallo sperimentatore ( n=179 ).
Gli endpoint secondari erano rappresentati da: percentuale di risposta complessiva e durata della risposta per RECIST v1.1.
KEYNOTE-006 è uno studio clinico multicentrico, randomizzato, su Pembrolizumab ( 10 mg/kg ogni due o tre settimane ) rispetto a Ipilimumab su 834 pazienti affetti da melanoma avanzato.
Nell’analisi ad interim programmata degli endpoint co-primari, Pembrolizumab ha dimostrato risultati di sopravvivenza libera da progressione e sopravvivenza globale superiori rispetto a Ipilimumab.
I tassi di sopravvivenza libera da progressione, calcolati a 6 e 9 mesi, per Pembrolizumab sono stati rispettivamente del 47% e del 40% per il gruppo con dosaggio a 2 settimane ( IC 95%, 0.58 [ 0.46, 0.72 ], p inferiore a 0.00001 ) ( n=279 ) e del 46% e del 42% per il gruppo con dosaggio a 3 settimane ( IC 95%, 0.58 [ 0.47, 0.72 ], p inferiore a 0.00001 ) ( n=277 ), rispetto al 27% e al 16% di Ipilimumab ( n=278 ).
La sopravvivenza globale a 1 anno per Pembrolizumab è stato del 74% ( gruppo a 2 settimane ) ( IC 95%, 0.63 [ 0.47, 0.83 ], p = 0.00052 ) e del 68% ( gruppo a 3 settimane ) ( IC 95%, 0.69 [ 0.52, 0.90 ], p = 0.00358 ), rispetto al 58% per Ipilimumab.
Il rischio di morte era ridotto al 31% per i pazienti trattati con Pembrolizumab nel gruppo a 3 ( percentuale di rischio di 0.69 ) e del 37% nel gruppo a 2 settimane ( tasso di rischio di 0.63 ).
Gli endpoint secondari erano tasso di risposta globale e la durata della risposta per RECIST v1.1.
Le analisi di sicurezza a supporto dell’approvazione europea di Pembrolizumab si sono basate su 1.012 pazienti affetti da melanoma avanzato suddivisi in tre dosaggi ( 2 mg/kg ogni tre settimane o 10 mg/kg ogni due o tre settimane ) negli studi clinici KEYNOTE-001 e KEYNOTE-002 combinati.
Le reazioni avverse più comuni ( superiori al 10% ) con Pembrolizumab sono state diarrea ( 15% ), nausea ( 12% ), prurito ( 25% ), rash ( 25% ), artralgia ( 13% ) e affaticamento ( 33% ).
La maggior parte delle reazioni avverse sono state di severità di grado 1 o 2.
Le reazioni avverse più gravi sono state di tipo immunitario e correlate alle infusioni. ( Xagena Medicina )
Fonte: ASCO - American Society of Clinical Oncology - Meeting, 2017
Xagena_Salute_2017
Per appfondimenti: MelanomaOnline.net http://melanomaonline.net/